روش کار و آنالیز داده های realtime pcr
آموزش روش ریل تایم : آنالیز داده های ریل تایم (real time pcr)
آموزش روش ریل تایم : آنالیز داده های ریل تایم (real time pcr)
تفاوت pcr با تکنیک ریل تایم real time pcr
Real Time PCR بسیار شبیه به واکنش PCRمی باشد اما تفاوت آن با PCR معمولی به کار گرفتن یک نشانگر فلورسنت در واکنش جهت ردیابی محصول واکنش می باشد. این گزارش گرها به گونه ای طراحی میشوند که در صورت تکثیر DNA نور تولید کنند بنابراین نور بیشتر برابر است با تکثیر محصول و افزایش شدت نور ثبت شده در دستگاه با میزان محصول بدست آمده نسبت مستقیم دارد.
این تکنیک به دو روش تقسیم بندی می شود:
تشخیص غیر اختصاصی با استفاده از رنگ های باند شده بهDNA
دراینجا از رنگ های باند شده به DNA به عنوان گزارشگر فلوروسنت برای مشاهده واکنش PCR استفاده می شود. این فلوروسنت در سیکل متوالی بر اثر مضاعف شدن افزایش می یابد. با ثبت مقدار فلوروسنت ساتع شده در سیکل، می توان واکنش را در طول مرحله نمایی مشاهده نمود. اگر نموداری میان لگاریتم مقدار شروع واکنش و افزایش فلوروسنت گزارشگر ترسیم شود یک رابطه خطی مشاهده خواهد شد. اغلب از SYBR® Green به همراه DNA دو رشته ای به عنوان رنگ مخصوص گزارشگر استفاده می شود. این رنگ به شکاف کوچک از مارپیچ دو رشته ای DNA باند می شود. در داخل محلول, رنگ هایی که باند نشده اند فلوروسنت خیلی کمی را نشان می دهند و فلوروسنت زمانی به وضوح افزایش می بابد که رنگ به DNA دو رشته ای پیوسته شود SYBR® Green . تحت شرایط PCR پایدار وبا ثبات باقی می ماند. سطح مطلوبی از درجه حرارت موجب تنظیم القاء و نشر طول موج ها می شود. همان طور که پیشتر ذکر شد از اتیدیوم بروماید نیز برای تشخیص می توان استفاده کرد ولی به علت سرطان زا بودن آن کمتر استفاده می شود.
تشخیص اختصاصی با استفاده از شناساگرهای هدف
در این روش از تعدادی شناساگر الیگونوکلئوتیدی استفاده می شود که بر اساس رنگ فلوروسنت گزارشگربه همراه رنگ خاموش کننده ( (Quencher است .
شناساگرهای مورد استفاده در اینجا شامل: Molecular Beacons , TaqMan® Probes FRET Hybridization Probes و Scorpion® Primers می باشند.
آموزش ریل تایم پی سی آر real time pcr
آشنایی با مفاهیم پایه در تکنیک ریل تایم Real time PCR
آشنایی با مفهوم سی تی Ct در ریل تایم Real time
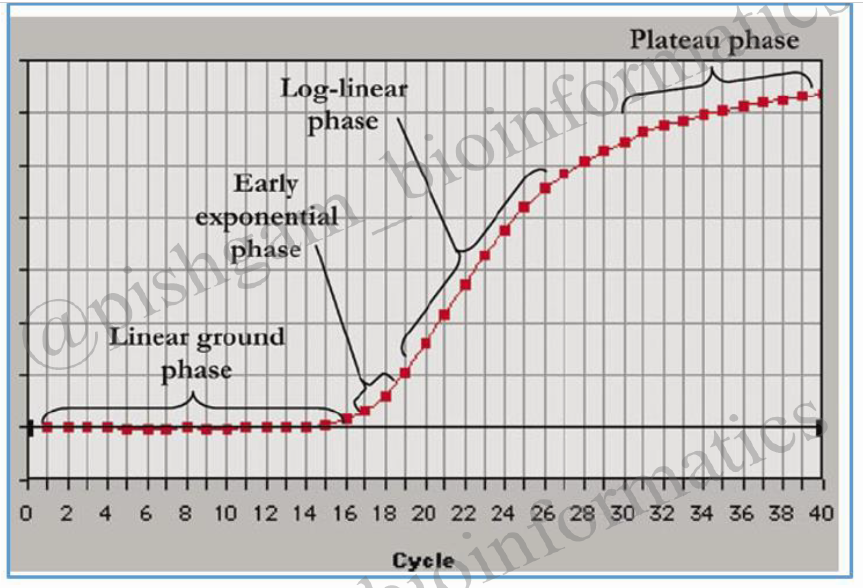
شکل فوق منحنی میزان محصول تکثیر یافته در Real time یا PCR را بر حسب سیکل های PCR نشان میدهد. به طور کلی Real time PCR چند مرحله دارد که عبارت است از:
Baseline rgion یا Linear phase در این مرحله هیچ گونه نوری قابل رویت نیست.
Exponential phase و Log liner phase: محصول دو رشته ای در هر چرخه دو برابر می شود و رشد تصاعدی مربوط به واکنش آغاز می شود.
The plateau phase : ترکیبات واکنش از بین می روند و افزایشی در میزان فلورسنت مشاهده نمی شود.
همان گونه که مشاهده می گردد تا ۱۵ سیکل اول در میزان محصولات تکثیر شده تغییر محسوسی دیده نمیشود اما از سیکل ۱۶ واکنش وارد یک فاز افزایشی می گردد که به آن فاز Exponential می گویند. سیکلی که در آن واکنش وارد فاز Exponential می گردد به میزان DNA اگوی اولیه بستگی دارد. یعنی هر چه میزان الکوی اولیه برای تکثیر بیشتر باشد بنابراین واکنش Real time یا PCR در سیکل پایینتری وارد فاز Exponential می گردد. به شکل زیر توجه نمایید:
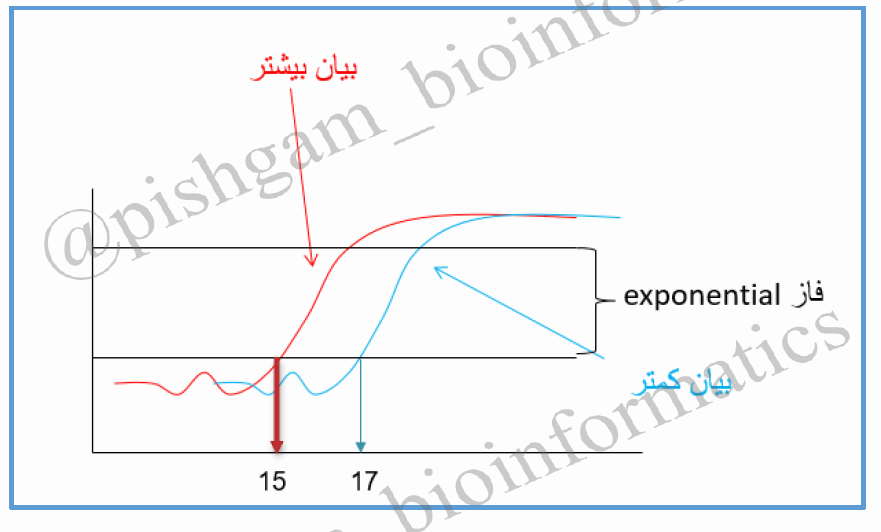
شکل فوق منحنی تکثیر ژن YHZ2 را در دو نمونه مختلف ( به عنوان مثال سرطانی و نرمال ) در واکنش Real time pcr نشان می دهد. نمونه قرمز رنگ دارای الگوی بیشتر از ژن فوق نسبت به نمونه آبی رنگ می باشد بنابراین زودتر وارد فاز exponential می شود. نمونه قرمز رنگ در سیکل ۱۵ و نمونه ابی رنگ در سیکل ۱۷ وارد فاز exponential می شوند. چون نمونه قرمز رنگ زودتر به فاز exponential رسیده و دارای الگوی بیشتری است می توان گفت که بیان ژن مورد نظر در نمونه قرمز رنگ بیشتر است. بنابراین هر چه قدر سیکلی که در آن میزان محصول pcr وارد فاز exponential می گردد کمتر باشد یعنی میزان الگوی اولیه (و به عبارتی بیان ژن) بیشتر بوده است.
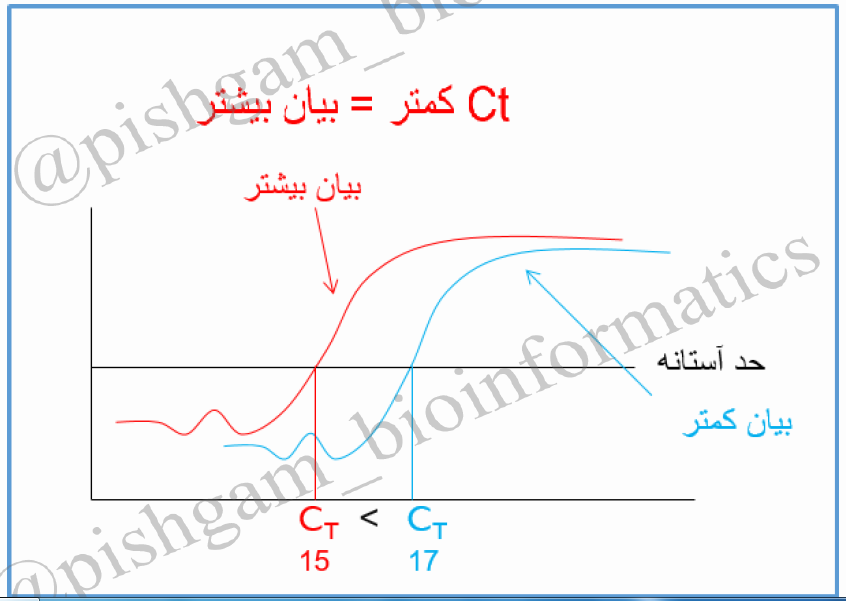
حال می توان به صورت توافقی سیکلی که در آن واکنش وارد فاز exponential می شود را به عنوان سیکل مرجع در نظر گرفت و بگوییم در شکل فوق سیکل مرجع برابر نمونه قرمز رنگ برابر ۱۵ و برای نمونه آبی رنگ برابر ۱۷ است. در تکنیک real time به این سیکل مرجع به اصطلاح سیکل استانه یا Ct (cycle of threshold) گویند که به این مفهوم است که در چه سیکلی محصولات real time از یک حد آستانه فراتر می رود؟ در شکل فوق ما حد استانه را ورود به فاز exponential در نظر گرفتیم اما در دستگاه های real time این حد آستانه بر اساس فرومول های خاصی تعیین میگردند. اما مفهوم Ct برای همه دستگاه ها یکسان است و به مفهوم سیکلی است که در آن محصولات real time از یک حد آستانه فراتر فراتر رفته است به شکل زیر توجه فرمایید
آشنایی با مفهوم ژن کنترل داخلی در واکنش ریل تایم Real time
در شکل فوق نوشته ایم که ” Ct کمتر = بیان بیشتر” و توضیح دادیم که چرا این گونه می باشد. اما به این نکته باید توجه شود که درست بودن این فرض با شرایط بسیاری وابسته است و این شروط به قدری سخت می باشند که زیاد نمیشود به عبارت ” Ctکمتر = بیان بیشتر” اعتماد نمود. به عنوان مثال فرض کنید در دو نمونه شکل فوق در نمونه قرمز رنگ ۴ میکرولیتر cDNA به عنوان الگو در واکنش Real time به کار رفته است در حالی که از نمونه آبی رنگ تنها یک میکرولیتر cDNA استفاده شده است. بنابراین میزان الگوی cDNA استفاده شده در نمونه قرمز زنگ ۴ برابر بیشتر از نمونه آبی رنگ بوده است. پس این خطا در استفاده متفاوت از میزان الگوهای cDNA بین دو نمونه مختلف سبب شده که نمونه قرمز رنگ زودتر به Ct برسد و ما به اشتباه بگوییم که میزان بیان ژن در نمونه قرمز بیشتر بوده است. پس به قطعیت نمی توان گفت که ” Ctکمتر = بیان بیشتر”. البته در آماده سازی واکنش ها در نمونه ها جهت Real time این نوع خطا به این شدت نمی باشد و ممکن است تفاوت بین الگوهای cDNA مورد اسفاده به کمتر از ۰٫۵ میکرولیتر برسد. اما خطاهای دیگری میتواند رخ بدهد. مثلا ممکن کیفیت استخراج RNA نمونه قرمز بسیار بهتر از کیفیت استخراج RNA نمونه آبی رنگ باشد و این سبب شده که cDNA ساخته شده برای این نمونه کیفیت بیشتری داشته باشد و برای همین کیفیت بیشتر نمونه زودتر به Ct برسد. و یا ممکن است کیفیت ساخت cDNA بین دو نمونه متفاوت باشد. بنابراین بروز این گونه خطاهای آزمایشگاهی سبب میشود که نتوان به Ct به عنوان یک پارامتر جهت مقایسه دو نمونه اعتماد نمود. حتی اگر فرض نمود که برای دو نمونه مختلف تمام شرایط آزمایشگاهی و کیفیت کارهای انجام شده کاملا یکسان باشد باز نمیتوان شرایط یکسان را برای تمام نمونه ها در نظر گرفت برای مثال جمع آوری نمونه کافی که از قسمت های سرطانی و با عمل جراحی از افراد مختلف به دست می آیند ممکن است چندین ماه به طول بیانجامد که خود این سبب تغییر در میزان کیفیت الگو در واکنش Real time میگردد.برای حل مشکل فوق ما میتوانیم از ژن هایی استفاده کنیم که اثبات شده است بیان آن ها در تمام نمونه ها یکسان است مانند ژن های GAPDH، ACTIN، و یا RPLP0 . ازآنجایی که بیان بین این ژن ها در تمام نمونه ها باید یکسان باشد در صورتی که بین Ct این ژن ها در نمونه های مختلف اختلافی مشاهده گردد، به این معنی است که شرایط آزمایش برای همه نمونه ها یکسان نبوده و با توجه به این ژن ها میتوان Ct مربوط به ژن مورد بررسی خود را اصلاح نمود. به ژن های GAPDH، ACTIN، و RPLP0 ژن های کنترل داخلی در Real time گویند. این ژن ها به دلیل اینکه برای حیات سلول ها ضروری می باشند معمولا دارای بیان بیشتر نسبت به سایرژن ها می باشند (Ct کمتری دارند).
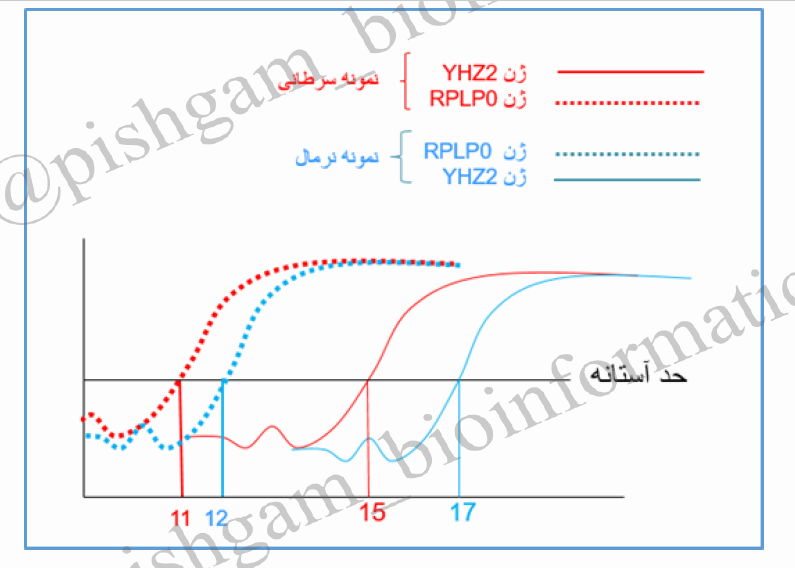
در شکل فوق بیان ژن YHZ2 در یک نمونه سرطانی و یک نمونه نرمال مورد بررسی قرار گرفته است همچنین بیان ژن RPLP0 به عنوان کنترل داخلی مورد بررسی قرار گرفته است پس در واقع برای هر نمونه ما بیان دو ژن را مورد برسی قرار داده ایم. در آنالیز این داده ها به اولین نکته ای که باید توجه شود کیفیت ساخت cDNA می باشد. شما به Ct ژن کنترل داخلی در دو نمونه نگاه کنید در مواردی ساخت cDNA دارای کیفیت مناسب باشد باید Ct ژن های کنترل داخی از ۲۵ کمتر باشد چون ژن های کنترل داخلی به دلیل اینکه برای حیات سلول ها ضروری می باشند معمولا دارای بیان بیشتر نسبت به سایر ژن ها می باشند. به دومین نکته ای که باید توجه کرد Ct ژن YHZ2 در دو گروه نرمال و سرطانی می باشد، در واکنش Real time مانند واکنش PCR معمولی از کنترل منفی استفاده میگردد پس Ct ژن YHZ2 در دو گروه نرمال و سرطانی باید از Ct نمونه های کنترل منفی کمتر باشد (کنترل ها در شکل نشان داده نشده اند). نکته سوم اینکه در واکنش Real time معمولا Ct های بالای ۳۸ قابل قبول نیستند چون این ژن ها داری بیان بسیار بسیارکمی بوده و برای بررسی این ژن ها بهتر است کیفیت ساخت cDNA را افزایش داد تا Ctها پایین تر بیایند.
آشنایی با مفهوم دلتا سی تی dCt در بیان ژن ریل تایم real time
حال به آنالیز داده های شکل فوق بپردازیم. همان گونه که مشاهده میشود بین Ct های ژن کنترل داخلی RPLP0 در بین نمونه های سرطانی و نرمال یک Ct تفاوت وجود دارد. بنابراین باید این تفاوت را در Ctهای ژن YHZ2 بین نمونه سرطانی و کنترل اعمال نماییم و به قول معروف داده ها که همان Ctها هستند را نرمال نماییم ( این نرمال نمودن به معنی نرمال یا سرطانی بودن نیست). برای نرمال کردن داده ها Ct ژن مورد بررسی را در تک تک نمونه ها از Ct ژن کنترل داخلی همان نمونه تفریق میکنیم. از آنجایی که داده های نرمال برای هر نمونه از تفریق Ct ژن مورد نظر از Ct ژن کنترل داخلی به دست آمده است داده نرمال شده را دلتا Ct (∆Ct)می نامیم.
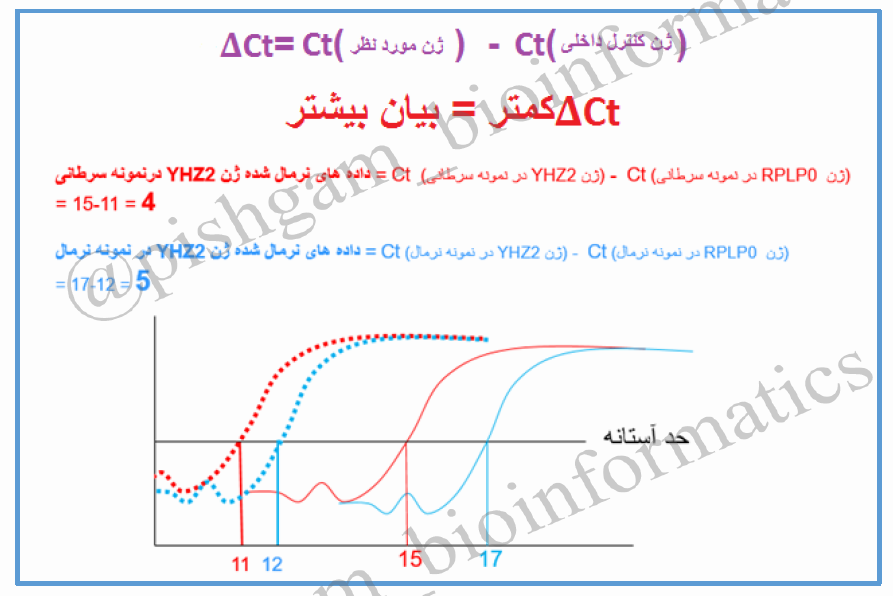
در شکل فوق محاسبات نشان میدهد که ∆Ct برای ژن YHZ2 در نمونه سرطانی برابر ۴ و در نمونه نرمال برابر ۵ می باشد. حال میتوان گفت ∆Ct کمتر = بیان بیشتر.
آشنایی با مفهوم Fold change در بیان ژن
در هنگامی که ما مقایسه نسبتی بین دو یا چند گروه انجام می دهیم ( مانند مثال فوق) بهترین راه بیان نتیجه آزمایش به صورت fold change می باشد. مفهوم fold change همان “چند برابر” می باشد به عنوان مثال بیان ژن YHZ2 در نمونه های سرطانی نسبت به نمونه نرمال چند برابر می باشد؟ این جمله یعنی اگر بیان ژن YHZ2 در نمونه نرمال برابر ۱ باشد بیان آن در نمونه سرطانی برابر چند است؟
قبل از توضیح محاسبه fold change در real time به این مثال توجه فرمایید وزن فرد A برابر ۶۰ کیلوگرم و وزن فرد B برابر۱۲۰ گیلوگرم است. Fold change فرد A و B نسبت فرد A چه قدر است (توجه داشته باشید که در اعلام نتایج باید Fold change فرد A نسبت خودش هم ذکر شود زیرا برای بررسی های آماری مورد نیاز می باشد) ؟

آشنایی با مفهوم دلتا دلتا سی تی ddCt در بیان ژن بوسیله ریل تایم real time
در مثال وزن باید توجه داشت که وزن ارائه شده در مقیاس خطی بوده و لگاریتمی نبوده بنابراین بر هم تقسیم شده اند. اما ∆Ct از نوع لگاریتمی برپایه ۲ می باشد ( زیرا در real time هر سیکل محصول ما ۲ برابر می شود). بنابراین باید ∆Ct ها را به جای تقسیم کردن از هم تفریق نمود. پارامتر جدید را که از تفریق ∆Ct ژن مورد نظر در نمونه سرطانی از ∆Ct نمونه نرمال به دست آمده است داده نرمال شده را دلتا دلتا Ct (∆∆Ct)می نامیم.

ابتدا گفتیم ” Ct کمتر = بیان بیشتر” و سپس آن را اصلاح کردیم و گفتیم “∆Ct کمتر = بیان بیشتر” و سپس گفتیم ” ∆∆Ct کمتر = بیان بیشتر” اما اکنون میخواهیم بگوییم ” fold change بیشتر = بیان بیشتر” پس برای این منظور ابتدا باید ∆∆Ct را در عدد (۱-) ضرب نمود پس اکنون می گوییم ” -∆∆Ct بیشتر= بیان بیشتر” (-∆∆Ct همان fold change به صورت لگاریتمی بر پایه۲ می باشد) .همان گونه که قبلا گفته شد Ct، ∆Ct و ∆∆Ct بر اساس لگاریتم بر پایه ۲ هستند بنابراین باید آن ها را به حالت خطی در اورد، پس ۲-∆∆Ct بیانگر fold change برای هر نمونه خواهد بود. به شکل زیر توجه فرمایید.

در نهایت Fold change برای نمونه نرمال برابر ۱ و برای نمونه سرطانی برابر ۲ می باشد یعنی بیان ژن در نمونه سرطانی ۲ برابر نمونه نرمال می باشد.
آموزش عملی آنالیز داده های ریل تایم Real time
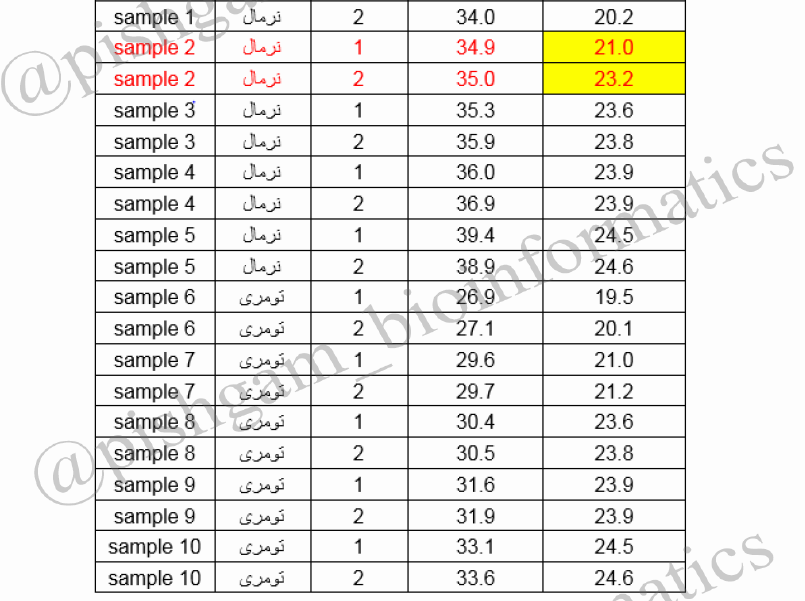
حال که با مفاهیم اولیه آنالیز داده در تکنیک Real time آشنا شدید، یک نمونه واقعی از داده های Real time را مورد بررسی قرار می دهیم. در این بررسی بیان ژن YHZ2 در ۵ نمونه سرطانی و ۵ نمونه نرمال مورد بررسی قرار گرفته است. یکی از مسائل مهم در آزمایش های بیولوژیکی اصل تکرار آزمایش می باشد بنابر این که هر نمونه را دو بار ( در یک واکنش Real time) بررسی نموده ایم. جدول Ct ها برای نمونه ها و تکرارها به صورت زیر است.
تفسیر نتایج ریل تایم real time pcr
بررسی کیفیت نتایج ریل تایم real time pcr
مرحله اول: در بیشتر نمونه ها Ct ژن YHZ2 از ۳۸ کمتر می باشد. توجه کنید که در بیشتر نمونه های هر دو گروه نرمال وسرطانی نباید Ct ژن YHZ2 از ۳۸ بیشتر باشد. چون Ct بالای ۳۸ درReal time قابل قبول نمی باشد. اما اگر در گروه نرمال همه Ctها بالای ۳۸ بود اما در گروه سرطانی اکثرا زیر ۳۸ باشد این Ct ها قابل قبول هستند زیرا می توان گفت این ژن در گروه نرمال بیان ندارد اما در گروه تومری بیان دارد ( یا برعکس).
تفسیر نمودار ریل تایم real time pcr: منحنی ذوب (melt curve)
مرحله دوم: برای هر دو ژن YHZ2 و RPLP0 در دو تکرار یک نمونه، نباید اختلاف Ct بیش از ۱ بین تکرارها باشد. اختلاف Ct ژن RPLP0 در تکرارهای نمونه شماره ۲ برابر ۲/۲ می باشد بنابراین این نمونه باید از انالیز ها بیرون گذاشته شود (به شکل زیر توجه کنید).
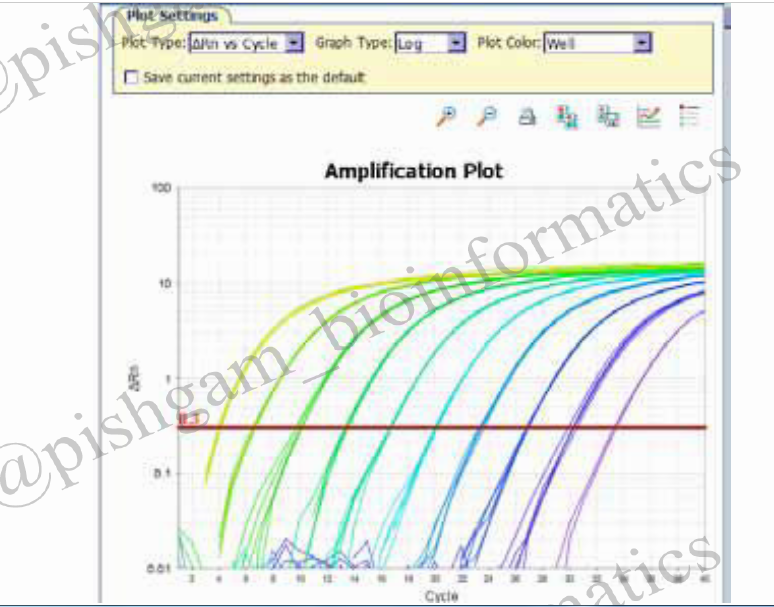
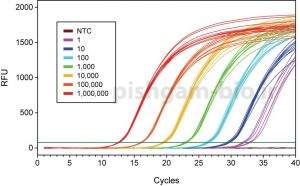
شکل فوق منحنی تکثیر دستگاه Real time است. در این شکل ۱۰ نمونه بررسی شده اند که با رنگ های مختلف نشان داده شده اند. هر نمونه ۵ بار تکرار شده است و مشاهده می شود که منحنی همه تکرارهای یک نمونه برروی هم منطبق میباشند. اما در صورتی که یک تکرار منحنی آن با تکرار های دیگر منطبق نباشد باید آن تکرار از بررسی ها حذف شود.
مرحله سوم: بررسی منحنی ذوب نمونه ها. هرژن دارای منحنی ذوب خاص خود در واکنش Real time میباشد بنابراین تمام منحنی های یک ژن در تمام نمونه ها باید با هم منطبق باشند به شکل های زیر توجه کنید. همچنین باید تمام منحنی ها تک قله باشند.
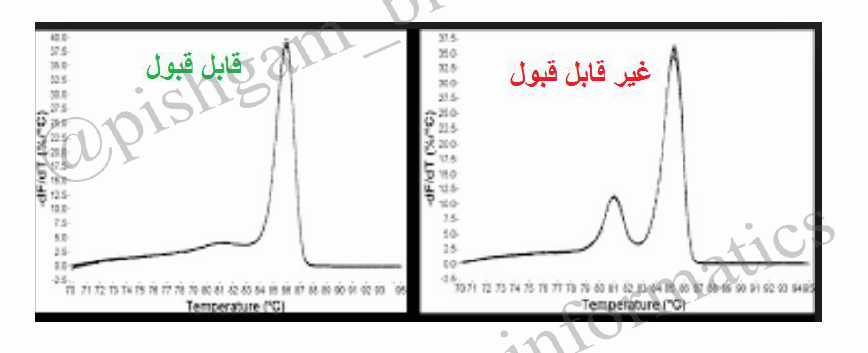
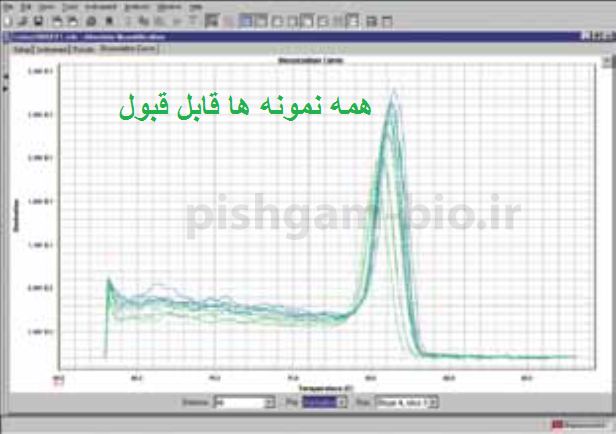
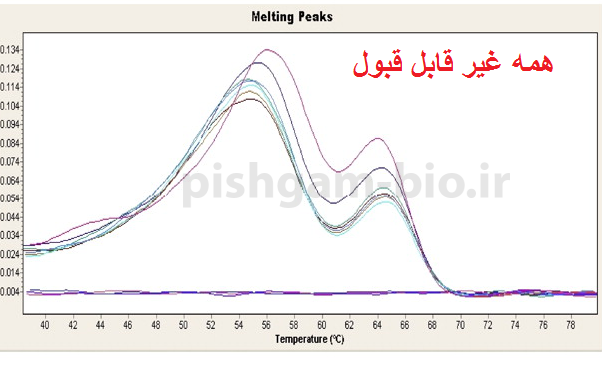
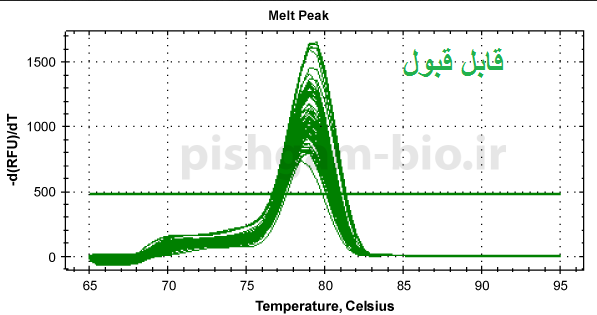
شکل فوق: توجه کنید که قله ها همه باید روی یک دما باشند ولی نیازی نیست ارتفاع قله ها یکسان باشد
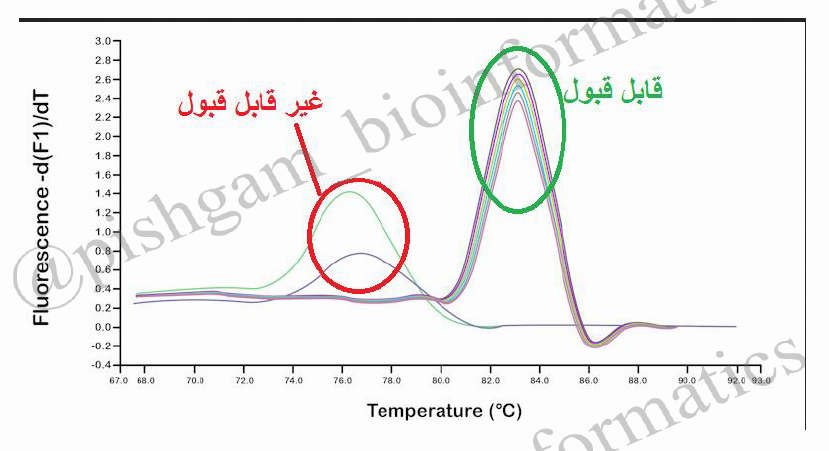
پس نمونه هایی که منحنی ذوب آن ها برای هر دو ژن با سایر نمونه ها منطبق نیست باید حذف شوند. توجه کنید ژن YHZ2 و ژن کنترل داخلی باید جدا گانه مورد بررسی قرار گیرند و نیازی نیست منحنی های این دو ژن با هم منطبق باشد.
بعد از حذف نمونه های مردود نوبت به انالیز داده ها میرسد در این مرحله چون تمام تکرار ها در یک واکنش Real time به صورت هم زمان بررسی شده اند باید از Ct هر تکرار میانگین گرفت و با ct میانگین کار کرد ( توجه شود که در مرحله گرفتن میانگین ما یک نمونه واحد داریم که ۲ بار تکرار شده است برای همین میانگین میگیریم. اما اگر نمونه ما چند نوع بود مثلا یک تیمار یکسان که دو بارتکرارشده است، دیگر نباید بین تکرار تیمارها میانگین گرفت)
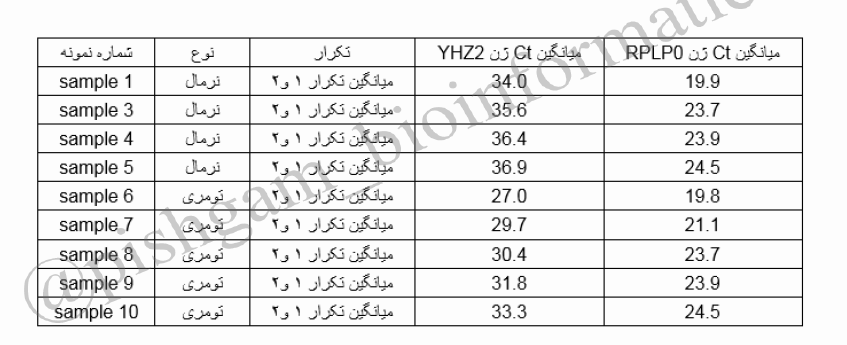
در جدول فوق برای همه تکرارها میانگین گرفته شده است. مرحله بعد نرمال کردن داده ها می باشد که باید میانگین Ct ژن YHZ2 درهر نمونه از میانگین Ct ژن RPLP0 در همان نمونه تفریق شود تا ∆Ct به دست آید.

در جدول فوق ∆Ct ها محاسبه شده اند.
حال نوبت میرسد به محاسبه Fold change، یعنی بیان این ژن در نمونه های تومری چند برابر نمونه های نرمال است. برای این کار ابتدا فرمول ۲-∆∆Ct را به یک شکل دیگر می نویسیم. به شکل زیر توجه کنید:

در شکل فوق ∆Ct2 مربوط به نمونه های تومری و ∆Ct1 مربوط به نمونه های نرمال می باشد. پس ابتدا ما برای تمام نمونه ها ۲-∆Ct را محاسبه می کنیم.
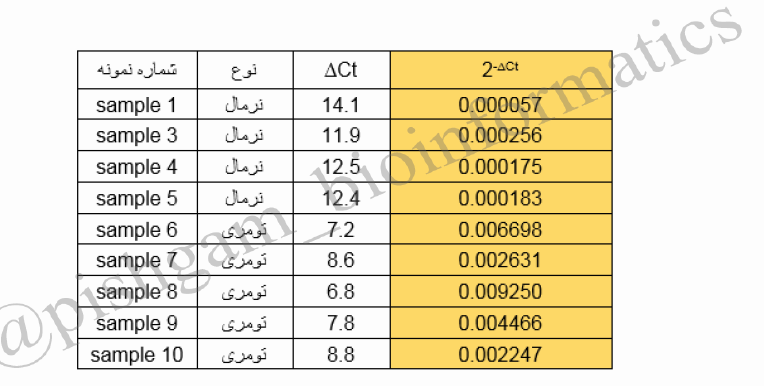
در جدول فوق مقادیر۲-∆Ct برای هر نمونه جداگانه بررسی شده است به مقادیر محاسبه شده در فوق سطح بیان نسبی ژن (relative expression) می گویند. حال Fold change برای هر نمونه از گروه های تومری و نرمال به صورت زیر محاسبه می گردد.

پس ابتدا میانگین سطح بیان نسبی تمام نمونه های نرمال را محاسبه میکنیم و سپس Fold change تمام نمونه ها (حتی نمونه های نرمال) را نسبت به میانگین فوق محاسبه می کنیم
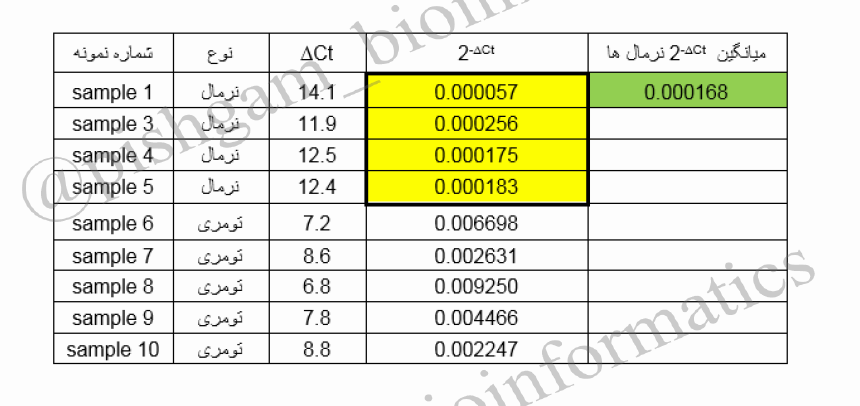
در جدول فوق میانگین سطح بیان نسبی تمام نمونه های نرمال (نمونه های هایلایت زرد شده) را محاسبه نموده ایم (هایلایت سبز) و سپس باید ۲-∆Ct هر نمونه را (حتی نمونه های نرمال) بر میانگین فوق تقسیم نماییم تا Fold change تمام نمونه ها به دست اید.
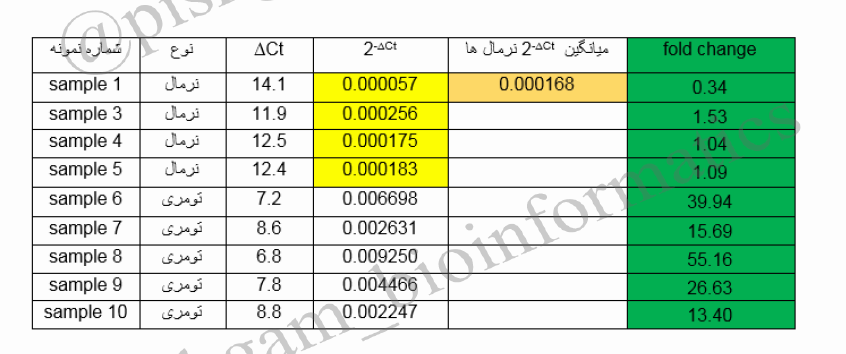
در جدول فوق Fold change تمام نمونه ها نسبت به میانگین سطح بیان نسبی نمونه های نرمال محاسبه شده است. حال Fold change ژن YHZ2 در نمونه های تومری نسبت به نرمال برابر است با میانگین Fold change همه نمونه های تومری که برابر است با ۳۰٫۱۶٫
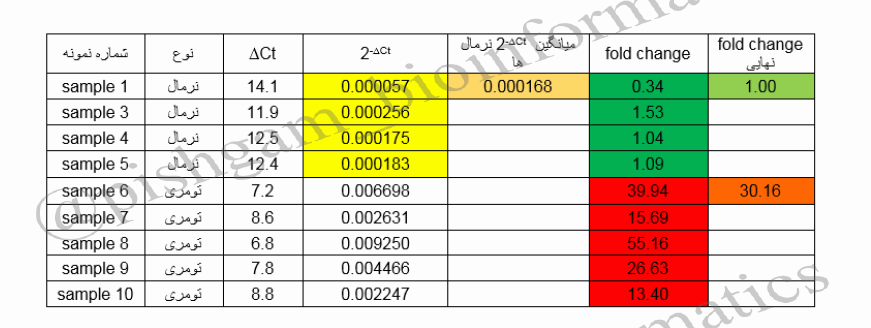
در جدول فوق مشاهده می فرمایید که Fold change نرمال ها نسبت به خودشان برابر ۱ و Fold change تومری ها نسبت به نرمال ها برابر ۳۰/۱۶ شده است.
انجام انالیز آماری داده های ریل تایم Real time
در صورتی که بخواهیم تست معنی داری و محاسبه p-value را برای نتایج فوق انجام دهیم نمی توان از خود Fold change برای بررسی های استفاده نمود وباید از حالت لگاریتمی آن ها مانند ∆Ct یا ∆∆Ct استفاده نمود برای مثال در جدول فوق می توانید از ستون Fold change (ستون سبز و قرمز رنگ) بر پایه ۲ لگاریتم بگیرید تا -∆∆Ct به دست آید وازآنها برای آزمون تی بین گروه های نرمال و توموری استفاده کرد. به دلیل اینکه در استفاده از داده های لگاریتمی برای محاسبه p-value بین افراد ( اغلب ناآگاه به علم آمار) تردید وجود دارد می توانید مقاله زیر را که در مورد آنالیز داده های Real time می باشد به عنوان رفرنس ارائه دهید.


یک اطلاعات مفید و مختصر ارایه دادید، خیلی عالی،ممنونم
از ازائه اطلاعات ارزنده شما بسیار ممنون و سپاسگزارم
من با دستورالعمل شما محاسبه را انجام دادم یعنی دلنا ct به دست آمده از گروه کنترل و بیمار را توان منفی پایه ۲ قرار دادم و حاصل هر کدام را بر میانگین همین دست آورد از گروه نرمال تقسیم کردم. اما وقتی حاصل منفی دلتا دلتا ct را توان پایه ۲ قرار می دهم عدد دیگری به دست می آید در صورتی که باید نتیجه هردو یکی باشد.
مطالب خیلی کامل بود و نیاز من رو برای مرور وبلاگ ها و سایت های دیگه مرتفع کرد،
بسیار ممنونم🙏🙏🙏
فرق فولد چنج میانگینها با میانگین فولد چنجها در تعداد زیاد بیمار چیست . ایا فرقی با هم دارند؟
فرق فولد چنج میانگینها با میانگین فولد چنجها در تعداد زیاد بیمار چیست . ایا فرقی با هم دارند؟ از کدام باید استفاده کرد.
بسیار عالی و کاریردی بود سپاسگزارم