روش انجام وسترن بلات(Western blot) (توضیح کامل تئوری و مراحل عملی)
تکنیک بلاتینگ
در این تکنیک باندهای پروتئینی از ژل به غشایی ماننده نیتروسلولز که قابلیت اتصال و تثبیت پروتئین ها را دارد، منتقل می شوند. در عمل بلاتینگ مولکولهای پروتئین از زمینه ژل خارج می شوند و در سطح غشا در همان موقعیت قرار می گیرند. از این رو به سادگی و با مقدار کمتری از مواد میتوان به مطالعه آنها پرداخت، یا آنها را جدا نمود و مورد استفاده قرار داد. به منظور تشخیص پروتئین ها یا آنزیم های منتقل شده به غشا میتوان از لیگاندهای اختصاصی یا سوبستراهای مربوطه استفاده کرد. آنتی بادی ها از متداولترین موادی هستند که برای تشخیص اختصاصی پروتئین ها در غشا بکار می روند. از همین رو چنین روش هایی به ایمونوبلاتینگ معروفند.
شکل ۱) مراحل کامل شناسایی پروتئین با استفاده از تکنیک بلاتینگ
روشهای انتقال پروتئین
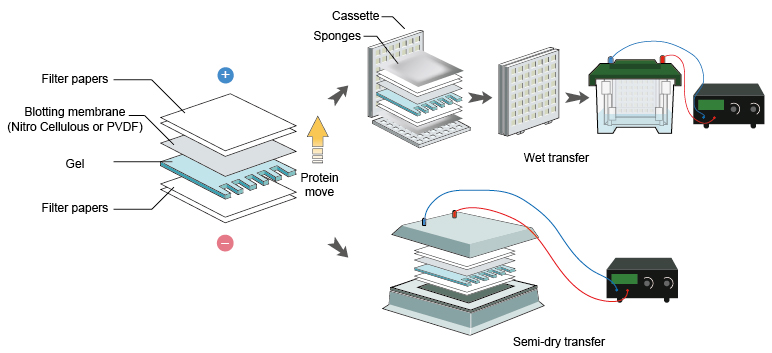
در اغلب موارد انتقال پروتئین از غشا به ژل با کمک نیروی الکتریکی صورت می گیرد. این نوع انتقال به انتقال الکتروفورزی معروف است. انتقال الکتروفورزی به دو صورت انجام می شود: انتقال در تانک که به انتقال تر معروف است و انتقال به روش نیمه خشک.
البته میتوان به طریق انتشار با خاصیت مویینگی یا پمپ خلا نیز پروتئین ها را انتقال داد.
غشاهای مورد استفاده در بلاتینگ
در عمل بلاتینگ معمولا از غشاهای نیتروسلولزی و یا پلی وینیلیدن دی فلورید (PVDF) استفاده می کنند. این دو غشا ظرفیت خوبی در اتصال به پروتئین ها دارند. نیتروسلولز ارزان تر است ولی ظرفیت مکانیکی کمی دارد و شکننده می باشد. اندازه منافذ نیتروسلولز بین ۰۵/۰ تا ۴۵/۰ میکرون متغیر می باشند. هرچه اندازه منافذ یک غشا کوچک تر باشد سطح مخصوص و ظرفیت اتصال آن بیشتر خواهد بود. دی آزو بنزیل اکسی متیل (DBM) ، دی آزو فنیل تیواتر (DPT) و نایلون از دیگر غشاهایی هستند که در موارد خاصی از عمل بلاتینگ بکار می روند. غشاهای نایلونی از ظرفیت و توان مکانیکی بالایی برخوردارند، اما بر خلاف سایر غشاها بار مثبت دارند. از این رو اغلب رنگ های آنیونی که برای پروتئین مورد استفاده قرار میگیرند، به آنها متصل میشوند. در مواردی که جداسازی پروتئین خاصی از غشا مورد نظر باشد، استفاده از غشاهای تعویض یون برای بلاتینگ مناسب می باشد. برای این کار قسمتی از غشا که حوای پروتئین مورد نظر است ، جدا می شود. سپس با قرار دادن قسمت جدا شده در بافر با PH یا قدرت یونی متفاوت ، پروتئین آزاد می شود.
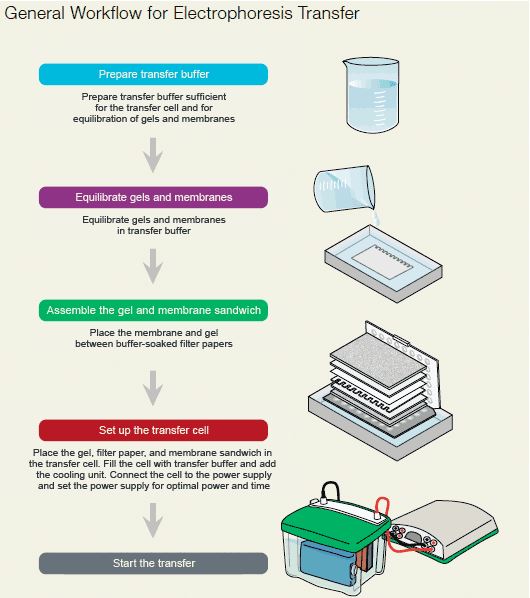
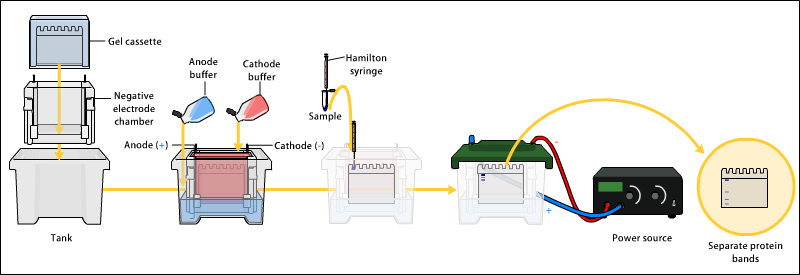
روش انتقال در تانک
روش انتقال در تانک شکل پایه ای انتقال به کمک الکتروفورز می باشد. بدین لحاظ غالبا این روش را معادل الکتروبلاتینگ می دانند. تصویر کلی این روش در شکل زیر آمده است.
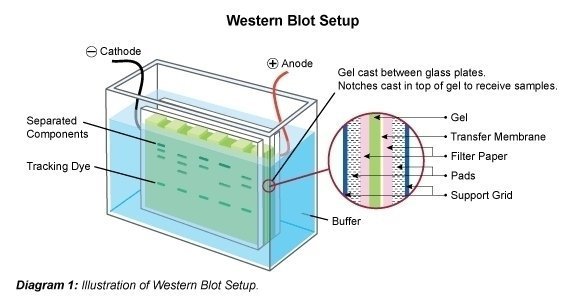
معمولا انتقال در تانک در بافر تریس-گلیسین انجام می گیرد. این بافر برای جداسازی انواعی از پروتئین ها که به روش SDS-PAGE جداشده اند مناسب است. وجوئ متانول در این بافر برای جلوگیری از تورم ژل، جداسازی SDS از پروتئین ها و بالا بردن ظرفیت اتصال به غشا است. اما ، متانول بخصوص در غلظت های بالا از عوامل بازدارنده انتقال پروتئین ها محسوب می شود. در بعضی موراد به منظور افزایش حلالیت پروتئین ها مقداری دترجنت (به عنوان مثال SDS با غلظت ۰۲/۰ درصد) به این بافر می افزایند. به هر حال باید توجه داشت که دترجنت ها به خصوص در غلظت های بالا از اتصال پروتئین ها به غشا جلوگیری می نمایند.
توضیح کامل تکنیک SDS-PAGE + رفع اشکال تکنیک الکتروفورز عمودی
مواد لازم جهت انجام تکنیک ایمونوبلات
- غشای نیتروسلولز با اندازه منافذ ۴۵/۰ میکرومتر یا غشای ایموبیلون (PVDF)
- بافر انتقال حاوی تریس ۲۵ میلی مولار، گلیسین ۱۹۲ میلی مولار و متانول ۱۵ درصد. برای تهیه آن ۶ گرم تریس باز و ۸/۲۸ گرم گلیسین را در حدود یک لیتر آب مقطر حل کنید. سپس ۲۰۰ میلی لیتر متانول اضافه کنید، حجم نهایی را با آب مقطر به ۲ لیتر برسانید (PH این محلول حدود ۳/۸ است و نیازی به تنظیم ندارد). بافر را در یخچال قرار دهید تا قبل از استفاده خنک گردد، چون حل شدن متانول در آب گرمازاست.
- کاغذ واتمن یا کاغذ الکتروفورز
روش آزمایش
- مقداری از بافر تانک را در یک ظرف پلاستیکی یا شیشه ای تمیز بریزید. ژل را پس از بریدن بخش متراکم کننده آن حداقل ۱۰ دقیقه در بافر قرار دهید.
- با کمک پنس و قیچی تمیز، یک ورقه از غشا به اندازه ژل ببرید. از تماس دست بدون دستکش با غشا خودداری کنید. غشا را با آب مقطر (برای غشای نیتروسلولز) یا متانول (برای غشای PVDF) خیس کنید و در ظرف حاوی بافر انتقال دهید. چندین لایه کاغذ صافی متناسب با ابعاد ژل تهیه و همراه اسفنج ها در بافر خیس کنید و در بافر خیس کنید. سپس مطابق شکل زیر اجزای گفته شده را روی هم قرار دهید. این مجموعه از پایین به بالا شامل اسفنج، چند لایه کاغذ صافی، ژل، غشا، چند لایه کاغذ صافی و لایه اسفنج می باشد. بعد از گذاشتن هر لایه، حباب های هوای احتمالی را با یک میله شیشه ای یا لوله آزمایش از حد فاصل لایه ها خارج کنید.
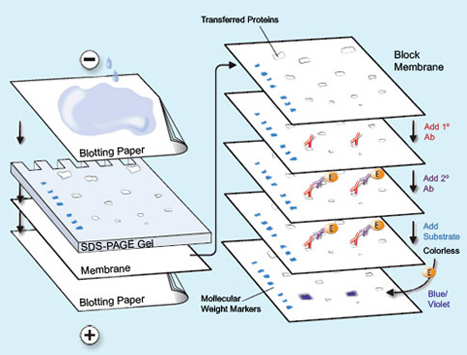
شکل ۳) انتقال به روش تر
- مجموعه بلات را در قاب پلاستیکی مربوطه محکم کنید و در تانک بلات که تا ارتفاع مناسب با بافر پر شده است، قرار دهید. سپس به مدت ۱-۴ ساعت در شدت جریان ۲۰۰-۴۰۰ میلی آمپر الکتروفورز نمایید.
انتخاب بافر در الکتروبلات
انتخاب بافر و استفاده از متانول در بافر بستگی به نوع پروتئین های مورد مطالعه ، شرایط ژل ، نوع الکتروفورز و نوع غشا دارد. همانگونه که قبلا نیز ذکر شد، بافر تریس-گلیسین- برای انتقال اغلب پروتئین ها مناسب می باشد. پروتئین ها در این بافر معمولا بار منفی دارند و به طرف آند حرکت می کنند. اتصال SDS به پروتئین ها (برای مثال در SDS-PAGE) نیز به تشدید بار منفی و حرکت آنها کمک می کند. با این حال در بعضی موارد تغییر شرایط بافر تریس-گلیسین یا انتخاب بافر دیگر میتواند انتقال را تسهیل نماید. به عنوان مثال، تجربه نشان میدهد که با حذف متانول در بافر تریس-گلیسین انتقال گلیکوپروتئین های بزرگ به راحتی صورت می گیرد. متانول با زدودن SDS از پروتئین ها و جمع کردن ژل باعث کاهش انتقال این مولکول ها می شود. SDS یک دترجنت آنیونی است و در انتقال پروتئین ها ( خصوصا پروتئین های با بار خالص مثبت) تاثیر گذار می باشد. بنا بر این در صورت نیاز، علاوه بر حذف متانول، می توان درصد بسیار کمی از آن را وارد بافر کرد.
انتقال در بافر [۱]CAPS 50 میلی مولار سریعتر صورت می گیرد و با تولید گرمای کمتری همراه است. بدین لحاظ در صورت لزوم می توان از این بافر به جای تریس-گلیسین استفاده کرد. در حالاتی که بلاتینگ به هدف تعیین توالی اسیدهای آمینه در پروتئین ها صورت می گیرد، بافر CAPS مناسب تر است. زیر حضور گلیسین در بافر موجب اختلال در تعیین توالی پروتئین ها می شود.
بافر بورات سدیم ۱۰ میلی مولار با PH=9.2 را برای انتقال گلیکوپروتئین ها، پلی ساکاریدها و لیپوپلی ساکاریدها توصیه می کنند. در این بافر ، بورات به واحدهای قندی مواد فوق متصل می شود و به آنها بار منفی می دهد.
پروتئین های بازی که در شرایط اسیدی الکتروفورز میشوند، یا پروتئین هایی که با تکنیک ایزوالکتروفوکوسینگ جدا می شوند، را می توان در محلول اسید استیک ۷/۰ درصد به غشا انتقال داد. در این شرایط پروتئین ها بار مثبت دارند و به طرف قطب منفی حرکت می کنند.
رنگ آمیزی عمومی پروتئین ها در غشا
بعد از بلاتینگ پروتئین ها لازم است اطلاعاتی در مورد کیفیت و کمیت باندهای انتقال یافته بدست آید، یا پروتئین خاصی به هدف مطالعات بعدی (مثلا تعیین توالی) مشخص گردد. برای این کار می توان غشای نیتروسلولز یا PVDF را با مواد مختلف رنگ امیزی نمود . رنگ آمیزی پروتئین ها بسته به هدف آزمایش ممکن است به صورت قابل برگشت و یا غیر قابل بزگشت باشد. پانسو-اس، جوهر هندی، آمیدوبلک و کوماسی آبی از مواد متداول برای رنگ آمیزی عمومی پروتئین ها در غشا هستند. رنگ آمیزی ژل نیز کامل یا ناقص بودن انتقال پروتئین ها را نشان می دهد. باندهای پروتئین در ژل و غشا دقیقا هم موقعیت نمی باشند، زیرا ژل در طی متعادل سازی در محلول انتقال به دلیل وجود متانول ، مقداری کوچک می شود.
| ماده رنگ آمیزی | حساسیت (میکروگرم در باند) | نوع غشا |
| فاست گرین FG | ۵/۱< | نیتروسلولز، PVDF |
| پانسو-اس | ۵/۱< | نیتروسلولز، PVDF |
| کوماسی آبی R-250 | ۵/۱ | PVDF |
| آمیدوبلک ۱۰B | ۵/۱ | نیتروسلولز، PVDF |
| جوهر هندی | ۱/۰ | نیتروسلولز، PVDF |
| آهن کلوئیدی | ۰۳/۰ | نیتروسلولز، PVDF و نایلون |
| بیوتین و آویدین-پراکسیداز | ۰۳/۰ | نیتروسلولز، PVDF و نایلون |
| طلای کلوئیدی | ۰۰۴/۰ | نیتروسلولز، PVDF |
جدول ۱) موادی که برای رنگ آمیزی عمومی پروتئین ها در غشا بکار می روند.
رنگ آمیزی قابل برگشت با پانسو- اس
محلول رنگ آمیزی شامل پانسو-اس ۱/۰ درصد وزنی-حجمی در اسید استیک ۵ درصد حجمی -حجمی است. محلول اماده آن نیز توسط شرکت های مختلفی عرضه می شود. برای رنگ امیزی غشا را به مدت ۵-۱۰ دقیقه در مقدار کافی محلول رنگ قرار دهید. سپس با آب مقطر بشویید تا زمینه غشا بی رنگ گردد.
باندهای پروتئینی بعد از رنگ امیزی به رنگ قرمز در می آیند. اگر شستشو با آب ادامه یابد، باندها نیز بی رنگ می گردند. رنگ امیزی با پانسو-اس دخالتی در تشخیص باندها به روش اختصاصی (مثلا ایمونوبلاتینگ) یا در تعیین توالی اسیدآمینه ها ندارد. حساسیت این روش نشبتا پایین می باشد.
رنگ آمیزی قابل برگشت با آمیدوبلک
محلول رنگ امیزی شامل آمیدوبلک با غلظت ۰۱/۰ درصد وزنی –حجمی در آب مقطر می باشد. برای رنگ آمیزی، غشا را ۲۰-۳۰ دقیقه در مقدار کافی محلول رنگ قرار دهید. سپس با آب بشویید تا زمینه غشا بیرنگ گردد. رنگ باندهای پروتئینی به تدریج ضعیف و بالاخره ناپدید می شود.
رنگ آمیزی غیر قابل بازگشت با کوماسی بلو
محلول رنگ امیزی شامل کوماسی بلو R-250 با غلظت ۱/۰ درصد وزنی حجمی در محلول اسید استیک ۷ درصد حجمی-حجمی و متانول ۵۰ درصد حجمی-حجمی در آب مقطر است.
محلول رنگ بر شامل اسید استیک ۷ درصد و متانول ۵۰ درصد در آب مقطر است. رنگ امیزی ژل با کوماسی بلو نیز با همین محلول ها صورت می گیرد.
غشا را ۱۵ دقیقه در مقدار کافی محلول رنگ قرار دهید. محلول رنگ را تخلیه کرده، غشا را در محلول رنگ بر بشویید تا زمینه آبی آن بی رنگ گردد. سپس غشا را در آب مقطر بشویید.
کوماسی بلو برای رنگ آمیزی پروتئین ها در PVDF مناسب است. این نوع رنگ را برای رنگ آمیزی نیتروسلولز بکار نبرید. زیرا زمینه آن شدیدا رنگی می شود.
رنگ آمیزی غیر قابل برگشت با آمیدوبلک
محلول رنگ آمیزی شامل آمیدوبلک آمیدوبلک ۵/۰ درصد وزنی حجمی، اسید استیک ۵ درصد حجمی-حجمی و متانول ۵۰ درصد حجمی-حجمی در آب مقطر است.
محلول رنگ بر شامل اسید استیک ۵ درصد و متانول ۵۰ درصد در آب مقطر است.
غشا را ۵ دقیقه در محلول رنگ بر قرار دهید. محلول رنگ آمیزی را تخلیه کنید و غشا را با محلول رنگ بر بشویید تا زمینه آبی رنگ شود.
رنگ آمیزی مارکرهای پروتئینی
تعیین برخی از خصوصیات پروتئین ها همچون اندازه یا نقطه ایزوالکتریک (PI) با استفاده از مارکر های پروتئینی صورت میگیرد. برای تشخیص مارکرها در غشا می توان از روش های زیر کمک بگیرید.
- قسمت مربوط به مارکرها را از بقیه غشا جدا نمایید و با یکی از روشهای غیر قابل برگشت که در صفحات قبل به آنها اشاره شد، رنگ آمیزی نمایید (PVDF را با کوماسی و نیتروسلولز را با آمیدوبلک رنگ کنید.)؛ سپس این بخش از غشا را خشک نمایید و در کنار بقیه نتایج قرار دهید.
- بسته به نوع برند موقعیت مارکرها و تعداد باندشان متفاوت است.
- می توان شکل بیوتینه شده مارکرها را تهیه کرد و یا مارکرها را در آزمایشگاه به بیوتین متصل نمود. تحت چنین شرایطی با در اختیار داشتن کونژوگه آویدین-پراکسیداز یا آویدین و کونژوگه آنتی آویدین-پراکسیداز می توان موقعیت مارکرها را مشخص نمود.
- آلبومین مرغی و آلبومین گاوی از پروتئین هایی هستند که در بسیاری از انواع مارکرها وجود دارند. با در اختیار داشتن آنتی بادی ضد این دو پروتئین به صورت کانژوگه با آنزیم (یا آنتی بادی ضد آنها و آنتی بادی ثانویه کانژوگه) می توان موقعیت آنها را در غشا تعیین ساخت. این روش زمانی قابل اجرا است که از این پروتئین ها به عنوان ماده مسدود کننده (inhibitor) در غشا استفاده نشود.
تشخیص اختصاصی پروتئین ها در غشا
تشخیص یا رنگ آمیزی اختصاصی باندهای پروتئینی در غشا، بر پایه واکنش آنها با لیگاندهای اختصاصی صورت می گیرد. برای انجام این کار مولکول های لیگاند را به طور مستقیم (اولیه) و یا غیر مستقیم (ثانویه) با مواد رادیواکتیو، فلورسانس، مواد رنگی یا آنزیم ها نشان دار می کنند و با کمک آنها به تشخیص اختصاصی پروتئین ها می پردازند. آنتی بادی ها از پر استفاده ترین لیگاندهای اختصاصی هستند که به اهداف مختلف تشخیص اختصاصی پروتئین ها می پردازند. آنتی بادی ها از پر استفاده ترین لیگاندهای اختصاصی هستند که به اهداف مختلف تشخیصی یا پژوهشی به کار می روند. اساس روش ایمونوبلاتینگ که اهمیت آن بر محققین علوم زیستی آشکار است، موید چنین ادعایی است.
تکنیک وسترن بلاتینگ
این روش که به ایمونوبلات نیز معروف است بر پایه واکنش اولیه آنتی بادی-آنتی ژن می باشد. در این روش پس از بلاتینگ پروتئین ها، ابتدا مناقط آزاد غشا مسدود می شود (مرحله بلوکه کردن). سپس شرایط واکنش آنتی بادی (برای مثال سرم بیمار) با باندهای پروتئینی فراهم می گردد و به دنبال آن ، با استفاده از ماکرومولکول های نشان دار (برای مثال آنتی بادی ضد ایمونوگلوبولین انسان که به آنزیم متصل است) نتیجه واکنش اولیه معلوم می گردد. امروزه وسترن بلاتینگ را به طور گشترده در تشخیص طبی و تحقیقات بکار می برند. اگرچه انجام این روش تابع یک سری اصول کلی است، با این حال شرایط و جزئیات آن وابسته به هدف آزمایش است.
مرحله مسدود سازی
غشاهای مورد استفاده در بلاتینگ ظرفیت زیادی برای گرفتن پروتئین ها دارند (برای مثال ۱۰۰ میکروگرم در هر سانتیمتر مربع از غشای نیتروسلولز) دارند. این خصوصیت اگرچه در جای خود بسیار مطلوب است ولی با اتصال غیر اختصاصی پروتئین های نشان دار در مراحل بعدی آزمایش به بروز اختلال در تشخیص منجر می شود. از این رو باید مناطق آزاد غشا قبل از مراحل تشخیص مسدود گردد. بهترین راه مسدود کردن این مناطق آزاد استفاده از پروتئین هایی است که خود با مواد نشان دار (مثل آنتی بادی) واکنش نمی دهد. کم هزینه بودن و سهولت تهیه از معیارهای اصلی انتخاب پروتئین مسدود کننده است. در جدول زیر نام و غلظت کاری تعدادی از پروتئین های مسدود کننده آمده است. دترجنت ها نیز می توانند از اتصال پروتئین ها به غشا جلوگیری کنند.توین-۲۰ معمولترین دترجنت مورد استفاده در این کار است. باید این نکته را توجه کرد که توین -۲۰ در غلظت های بالا (بیش از نیم درصد) در پاره ای موارد از اتصال لیگاند به پروتئین نیز جلوگیری میکند.
تشخیص با آنتی بادی
پس از بلاتینگ پروتئین ها و بلوکه کردن غشا، مرحله تشخیص اختصاصی را می توان انجام داد. همانگونه که قبلا نیز گفته شد ایمونوبلاتینگ در بسیاری از موارد به هدف تشخیص طبی است. در این موارد باندهای انتقال یافته شامل همه یا بخشی از پروتئین های پیکره میکروب (باکتری، ویروس یا قارچ) است که وجود یا عدم وجود آنتی بادی ضد سرم آنها در سرم انسان یا حیوان بررسی می گردد. شکل زیر نمونه ای از این نوع ایمونوبلاتینگ را نشان می دهد.
| ماده مسدود کننده | توضیحات |
| آلبومین سرم گاو | در غلظت ۲-۵ درصد در بافر (معمولا PBS) برای ۱-۲ ساع بکار می رود. برای مسدود کردن نایلون غلظت ۱۰ درصد آن به مدت ۱۲-۱۶ ساعت لازم است. |
| شیر خشک بدون چربی | در غلظت ۳ درصد بکار می رود. بسیار ارزان است. بدلیل محتوای قندی زیاد از اتصال لکتین ها یا آنتی بادی های ضد کربوهیدرات (به عنوان مولکول های نشان دار) جلوگیری می نماید |
| آلبومین مرغ | در غلظت ۱ درصد بکار می رود. |
| ژلاتین | در غلظت ۳/۰-۳ درصد بکار می رود. ژلاتین ماهی خصوصیات مناسب تری نسبت به ژلاتین پستانداران به عنوان ماده مسدود کننده دارد. |
| دترجنت (توین-۲۰) | غلظت بین ۱/۰-۰۵/۰ درصد آن کافی است. راحت و کم هزینه است. از واکنش های غیر اختصاصی بین پروتئین ها نیز جلوگیری می کند. |
مواد
- بافر تریس نمکی با PH 7.5 (TBS). این بافر شامل تریس ۲۰ میلی مولار و کلرید سدیم ۱۵/۰ مولار است.
- بافر تریس نمکی حاوری توین ۰۵/۰ درصد (TBS-T). به هر لیتر از بافر تریس نمکی ۵/۰ میلی لیتر توین- ۲۰ اضافه شود.
- آنتی بادی اولیه (سرم بیمار یا حیوان ایمن شده). در صورت لزوم با TBS-T رقیق می گردد.
- آنتی بادی ثانویه . این آنتی بادی ضد بخش ثابت آنتی بادی اول است و با آنزیم (پراکسیداز) کونژوگه شده است. رقت مورد نیاز از این آنتی بادی در TBS-T تهیه می شود.
- محلول سوبسترای آنزیم پراکسیداز شامل دی آمینو بنزیدین ۵/۰ میلی گرم در میلی لیتر و پراکسید هیدروژن ۱/۰ درصد در TBS است.
روش آزمایش
- پس از مرحله مسدودسازی، غشا را ۳ بار، هربار ۵ دقیقه در TBS-T بشویید. سپس ۱-۲ ساعت در آنتی بادی اول قرار دهید.
- غشا را ۴ بار هر بار ۵ دقیقه در TBS-T بشویید. سپس ۱-۲ ساعت در آنتی بادی ثانویه (آنتی بادی کانژوگه با پراکسیداز) قرار دهید.
- غشا را ۴ بار هر بار ۵ دقیقه در TBS-T بشویید. سپس آن را در معرض مقدار کافی از محلول سوبسترا قرار دهید. ظهور باندها معمولا ۵-۱۵ دقیقه طول می کشد. پس از ظهور باندها غشا را در آب مقطر زیاد بشویید. غشا را خشک کرده، در محل تاریک قرار دهید.
توجه شود که دی آمینوبنزیدین یک ماده بسیار سمی است. از تماس با آن خودداری کنید و در استفاده از آن دقت نمایید.
[۱] Cyclohexylamine) -1-propane sulfonic acid
آموزش تکنیک وسترن بلات (Western blot) _ زبان انگلیسی
آموزش تکنیک وسترن بلات(Western blot) _ زبان انگلیسی ۲
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
رفع اشکال تخصصی روش بلاتینگ نیمه خشک (سمی درای) | بیوتکنولوژی
راهنمای حل مشکلات احتمالی روش بلاتینگ نیمه خشک (سمی درای)
انتقال ضعیف
- زمان انتقال کم می باشد.بهتر است که زمان انتقال را زیاد کرد.
- نسبت بار به جرم غلط می باشد. پروتئین ها نزدیک به نقطه ایزوالکتریک خود در PH بافر دارای انتقال ضعیف میباشند. برای رفع این موضوع بهتر است به منظور افزایش انتقال پروتئین ها از بافر دارای خواص اسیدی و یا قلیایی قوی تر استفاده کرد.
- کاغذ صافی بسیار خشک میباشد. یا کاغذ در بافر کم و ناکافی خیس خورده است. یا در همان ابتدای عمل انتقال بافر خشک شده است. بهتر است که قبل از عمل انتقال کاغذ صافی کاملا در بافر خیسانده شود. تعداد صفحات کاغذ صافی را افزایش دهید، و یا از یک کاغذ صافی ضخیم تر استفاده کنید.
- جریان پاور افت می کند. فیوزهای آن را بررسی نمایید.
- درصد ژل خیلی زیاد میباشد. T (جمع مونومرها) و یا C (کراس لینکر ها) را کاهش دهید. در C به مقدار ۵% کوچکترین اندازه منافذ تولید می شود. با کاهش از این مقدار، اندازه منافذ بزرگتر خواهد شد و کیفیت انتقال بهتر خواهد شد.
- متانول موجود در بافر،موجب محدودیت عمل شستشوی پروتئین ها از ژل می شود. خارج نمودن متانول کیفیت انتقال بهتر خواهد شد، اما این عمل همچنین سبب کاهش اتصال به نیتروسلولز خواهد شد. از PVDF استفاده کنید.
- پروتئین در ژل رسوب کرده است. سعی کنید از SDS در بافر انتقالی استفاده کنید. SDS میتواند کیفیت انتقال را بهتر کند، اما میتواند کیفیت اتصال به نیتروسلولز را کاهش دهد و نیز واکنش پذیری بعضی پروتئین ها با آنتیبادیها را کم کند.
- تماس بین غشای بلات و ژل ضعیف می باشد. حباب های هوا یا رطوبت اضافه بین بلات و ژل قرار می گیرد. با استفاده از پیپت با دقت آن را روی کاغذ صافی به دو جهت غلط دهید تا رطوبت اضافه و حباب های هوا بین ژل و غشا بیرون بروند و تماس کامل حاصل شود. از یک کاغذ صافی ضخیم تر در ساندویچ ژل/غشا استفاده کنید. مطمئن شوید که هیچ گونه حبابی بین کاغذ صافی و ژل موجود نمی باشد.
- ژل کاملا در بافر انتقالی به تعادل نرسیده است. ژل باید در بافر انتقالی کاملا شسته شود تا از چروکیده شدن یا تورم آن در زمان انتقال جلوگیری شود. مدت زمان شستشو و یا تعداد دفعات شستشو را افزایش دهید.
- اگر چندین ژل همزمان در حال انتقال می باشند، ممکن است آلودگی متقاطع رخ دهد. برای رفع این مشکل از کیسه دیالیز دارای منافذ کوچکتر استفاده شود تا ساندویچ های ژل/غشا را از هم جدا کند. یا از کاغذ PVDF استفاده کنید تا با کیفیت بالاتری به قطعات کوچک متصل شوند.
- توان اعمال شده به سیستم انتقالی بالا می باشد. ولتاژ را کاهش دهید. هدایت پذیری بافر را بررسی نمایید. بافری که بدرستی تهیه نشده است موجب اعمال توان اضافی به سیستم انتقالی می شود.
اتصال ضعیف به غشای نیتروسلولز
- جهت انتقال در شرایط بهینه اتصال، پروتئین های جداشده توسط SDS-PAGE نیازمند متانول ۲۰ ٪ هستند. مطمئن شوید که بافر حاوی میزان کافی از متانول می باشد.
- پروتئین های بزرگتر از ۱۵ کیلودالتون ممکن است به طور ضعیفی به نیتروسلولز ۰٫۴۵ میکرونی متصل شوند و یا در هنگام آزمون از غشا شسته شوند. بهتر است در اینجا از غشای نیتروسلولزی ۰٫۲ میکرون استفاده شود. میتوان جهت بهبود اتصال، پروتئین ها را با گلوتارآلدهید کراس لینک داد.
- پروتئین ها را میتوان با SDS، NP-40 و چندین دترجنت دیگر از غشای نیتروسلولز جدا کرد. از دترجنت توین-۲۰ در شستشو و مراحل انکوبه نمودن با آنتی بادی استفاده شود. دترجنت ها را در بافر کامل خارج نمایید و یا میزانشان را کم نمایید. از فیکساسیون با گلوتارآلدهید استفاده شود.
- SDS موجود در بافرهای انتقالی موجب کاهش کیفیت اتصال پروتئین ها می شود. از متانول ۲۰ ٪ در بافر انتقالی استفاده شود و قبل از انتقال ژل را در بافر متانول به تعادل برسانید.
حساسیت کم تشخیص و یا واکنش پذیری کم
- راهنمای استفاده کیت بررسی شود.
- اتصال آنتی ژن ناقص است.
- زمان های واکنش آنتی بادی کافی نمیباشند. زمان های واکنش افزایش یابند.
- بارگیری نمونه کافی نیست. غلظت پروتئین برده شده بر روی ژل را افزایش دهید.
- ممکن است به منظور جلوگیری از دناتوره شدن در زمان انتقال، آنتی ژن نیازمند تنظیمات دمایی خاصی باشد. دستگاه های انتقالی تر ساخت دنا ژن تجهیز دارای سیرکولاتور می باشند، بنابراین بهتر است از این نوع انتقال استفاده شود.
- آنتی بادیهای مونوکلونال ممکن است آنتیژن دناتوره شده را شناسایی نکنند. اتصال آنتیبادیهای مونوکلونال و یا پلی کلونال دیگر را بررسی نمایید. پروتئین های نیتیو را بلات نمایید.
فیلم آموزشی روش بلاتینگ نیمه خشک (سمی درای) | Semi-dry blotting
فیلم آموزشی روش بلاتینگ نیمه خشک (سمی درای) | Semi-dry blotting
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦
رفع اشکال تکنیک وسترن بلات(Western blot)|بصورت کامل و تخصصی | بیوتکنولوژی
مشکلات احتمالی تکنیک وسترن بلات و راه حل
انتقال ضعیف پروتئین ها در بلاتینگ
دلیل:بالا بودن درصد ژل در الکتروفورز
حل:الکتروفورز در ژل نازک تر صورت گیرد.
دلیل:احتباس حباب های هوا در حد فاصل ژل و غشا
حل: اجزای بلات کاملا در بافر انتقال به تعادل برسند. بعد از افزودن هر لایه از مجموعه بلات حباب های هوا با لوله آزمایش (به عنوان وردنه) خارج گردد.
دلیل:کم بودن زمان انتقال
حل: انتقال در ولتاژ پایین تر در طول شب انجام گیرد.
دلیل:بالا بودن درصد متانول در بافر انتقال
حل: درصد متانول را به ۵-۱۰ درصد کاهش دهید.
دلیل:بالا بودن غلظت دترجنت ها (مثلا SDS)
حل: غلظت SDS در بافر انتقال را کاهش دهید.
دلیل: کاهش دانسیته بار منفی در پروتئین ها
حل: بافر با PH بالاتر انتخاب گردد.مقدار کمی SDS نیز به آن اضافه گردد.
دلیل: ضعیف بودن قابلیت اتصال غشا
حل: از غشای تعویض کننده یون یا غشای نایلون استفاده شود.
مشکل: رنگی شدن زمینه غشا در وسترن بلات
دلیل: عدم وجود توین -۲۰ در بافرهای رقیق کننده و شوینده
حل: توین-۲۰ در غلظت ۱/۰-۰۵/۰ درصد به بافر اضافه گردد.
دلیل: مسدودسازی ناقص (غلظت کم ماده مسدود کننده و یا زمان مسدودسازی)
حل: درصد ماده مسدود کننده و یا زمان مسدودسازی افزایش یابد.
دلیل: نا مناسب بودن پروتئین مسدودکننده (دارای ناخالصی های آنزیمی یا واکسن با آنتی بادی ها)
حل: نوع پروتئین مسدود کننده تغییر یابد یا از دترجنت ها استفاده شود.
دلیل: بالا بودن غلظت اولیه آنتی بادی اولیه و یا ثانویه (کانژوگه)
حل: آنتی بادی ها در رقت های بالاتر مورد استفاده قرار می گیرند.
دلیل: نا خالص بودن آنتی بادی ها و یا خراب شده کانژوگه ها
حل: از انواع خالص تر آنتی بادی استفاده شود. کانژوگه تازه تهیه گردد.
دلیل: ناکافی بودن مراحل شستشو و یا طولانی نشدن مدت انکوباسیون غشا در سوبسترای آنزیم
حل: مراحل شستشو و بطور کامل و به دقت صورت گیرد. مرحله انکوباسیون غشا در سوبسترای آنزیم به مدت ۲۰-۵ دقیقه کافی است.
مشکل: لکه ها یا نواحی سفید در بلاتینگ ممکن است در اثر گیرافتادن حباب و یا نواحی خیس نشده غشا باشند که پروتئین به آنها متصل نخواهد شد. هر دو مورد را می توان با دقت رفع نمود.
دلیل: دلیل آن می تواند سر هم نمودن ناصحیح ساندویچ وسترن و یا گیر افتادن حباب هوا در آن باشد.
مشکل: وجود زمینه بسیار تاریک در بلات:
دلایل:بلاک شدن ناقص غشا:
- افزودن غلظت مسدود کننده
- افزودن مدت زمان مرحله مسدود کردن
- افزایش دمای مرحله مسدود کردن
- استفاده از ماده مسدود کننده دیگر
آلودگی محلول مسدود کننده
راه حل:
- استفاده از یک پروتئین خالص مانند BSA یا کازئین به عنوان بلاک کننده
- از بافرهای بلاک کننده استفاده نکنید.
انکوباسیون با سوبسترا به مدت طولانی
راه حل:
- مدت زمان انکوباسیون با سوبسترای تشخیصی کم شود.
در صورتی که از ماده رنگ دار استفاده می شود، هنگامی که سطح نویز به سیگنال قابل قبول است بلات را از محلول سوبسترا بیرون آورده و در آب دیونیزه قرار دهید.
مقدار آنتی بادی زیاد است
راه حل:
- غلظت انتی بادی اولیه و یا ثانویه را کاهش و یا تعدیل نمایید.
- از یک تست آزمایشی دات بلات استفاده نمایید تا غلظت های آنتی بادی بهینه گردد.
- مدت زمان انکوباسیون را کم نمایید.
مشکلات مخصوص تانک بلاتینگ
- پروتئن بیش از اندازه بارگیری شده است.
- مقدار پروتئین بر روی ژل را کاهش دهید.
- غلظت SDS در بافر انتقالی را کاهش دهید.
- یک غشای دیگر اضافه کنید تا پروتئین اضافی به آن متصل گردد.
اتصال آنتی بادی به پروتئین ها در بافر مسدود کننده:
راه حل:
- استفاده از مواد مسدود کننده دیگر، مثلا: آلبومین، ژلاتین ، BSA ، کازئین و شیر خشک بدون چربی
در هنگام استفاده از سیستم بیوتئین- آویدین از شیر به منظور بلاک نمودن غشا ها استفاده نکنید. زیرا شیر حاوی بیوتئین می باشد.
زمان ناکافی بین گام های انکوباسیون
- افزایش مدت زمان و تعداد گام های شستشو (حداقل ۵×۵ دقیقه)
- از مقادیر بیشتر بافر شستشو استفاده کنید.
خشک شدن غشا در زمان گام های انکوباسیون بلاتینگ
راه حل:
- مطمئن شوید غشا کاملا در هنگام شروع فرایند خیس شده است و نیز مطمئن شوید که بلات در هر مرحله خشک نمی شود.
- مطمئن شوید که غشا در زمان انکوباسیون و شستشو با بافرها کاملا غوظه ور است.
از بین رفتن فعالیت آنتی بادی در اثر نگهداری بلند مدت
راه حل:
- استفاده از آنتی بادی تازه که در دمای ۲۰- درجه سانتیگراد نگهداری شده است.
- در صورتی که قرار است برای مدت زمان خیلی طولانی از آنتی بادی استفاده شود، بهتر است که آن را در دمای ۸۰- درجه سانتیگراد نگهداری کرد و آن را به بچ های خیلی کمی تقسیم نمود.
- از سیکل های فریز-دفریز آنتی بادی خودداری شود.
دمای انکوباسیون خیلی بالا
راه حل: استفاده از دمای انکوباسیون پایین تر
در صورتی که کاغذ PVDF دارای پس زمینه بیشتری نسبت به نیتروسلولز است، از نیتروسلولز استفاده کنید.
در صورتی که بافر آلوده است:
- از بافر تازه استفاده کنید .
- همه بافرها را قبل از استفاده با فیلتر ۲ میکرومتری فیلتر نمایید.
مشکل: پس زمینه لکه لکه
این مشکل می تواند ناشی از غشای خشک و یا شستشوی ناکافی باشد. هر دو مساله به راحتی قابل حل هستند اگر بلات را کاملا و در تمام مدت غوطه ور نگه داشت. باید در جابجایی دقت بیشتری شود تا از چنین آلودگی در آزمایشگاه ها جلوگیری شود.
نقاط ناهموار بر روی بلات و یا پس زمینه خالدار
پس زمینه خالدار و لکه ای می تواند به دلیل اتصال یک جسم خارجی به غشا، تجمع آنتی بادی، اسکنر کثیف و یا سطوح کثیف کاست های وسترن بلات باشد.
انتقال کاست های ژل بر روی بلات
دلیل مشکل:
- استفاده از پدهای فیبری باریک و یا آلوده
- مقادیر اضافی از پروتئین بر روی ژل بارگیری شدند و یا SDS خیلی زیادی در بافر LOADING استفاده شده است.
- بافر انتقال آلوده است.
آموزش تکنیک وسترن بلات (Western blot) _ زبان انگلیسی
آموزش تکنیک وسترن بلات(Western blot) _ زبان انگلیسی ۲
♦♦♦ در صورت داشتن هرگونه سوال در مورد این موضوع برای ما نظر بگذارید (در پایین همین صفحه). در اسرع وقت به تمامی سوالات شما توسط کارشناس مربوطه پاسخ داده خواهد شد. با تشکر ♦♦♦